Campagnes d'échantillonnage en Côte d'Ivoire, au Cambodge et en Guadeloupe (partie aquatique)
Dans le cadre du projet BCOMING, une série d'échantillonnages aquatiques (eau douce) a été réalisée en Côte d'Ivoire (mai 2023), au Cambodge (juillet 2023) et en Guadeloupe (octobre 2023) afin d'identifier les patrons de biodiversité des communautés aquatiques et leurs parasites dans les zones tropicales le long d'un gradient d'urbanisation, dans le but i) d'identifier les moteurs d'émergence des maladies et ii) de prévenir les risques de maladies. Notre équipe est composée du Dr. Marine Combe (CR, IRD), du Dr. Claudia Bommarito (PostDoc, IRD), du Prof. Rudy E. Gozlan (DR, IRD) et de Mme Chloé Lefebvre (Technicienne, IRD) de l'Institut National de Recherche pour le Développement Durable (IRD) et de l'Institut des Sciences de l'Evolution de Montpellier (ISEM), France. En tant qu'équipe responsable de l'échantillonnage aquatique, il était passionnant de finaliser ensemble les derniers détails de l'échantillonnage, de préparer et d'expédier le matériel, et enfin de voir les campagnes de terrain se dérouler.

CÔTE D'IVOIRE (Mai 2023)

Fig1 Carte des zones d'échantillonnage en Côte d'Ivoire. L'ADN électronique a été collecté dans trois sites aquatiques différents dans chaque zone. Les différentes couleurs illustrent a) le gradient d'urbanisation (vert pour les forêts vierges et vert clair pour les forêts fragmentées) et b) les zones d'échantillonnage (rouge, jaune et vert foncé pour les villages, le périmètre du parc national de Tai et la zone intérieure du parc national, respectivement).
En mai 2023, nous avons eu l'opportunité de réaliser le premier échantillonnage d'ADN électronique aquatique en Côte d'Ivoire, grâce à la collaboration de nos collègues du BCOMING, le Dr. Lorenzo Lagostina (Helmholtz Institute for One Health) et le Dr. Julien Cappelle (CIRAD). L'ADN environnemental est un outil émergent pour le suivi des populations aquatiques et semi-aquatiques dans les plans d'eau. L'ADN électronique peut être extrait directement d'échantillons environnementaux, tels que l'eau ou le sol, et permet de détecter la présence d'une espèce à partir d'une matrice ADN complexe sans qu'il soit nécessaire de capturer l'espèce ou de faire appel à des spécialistes pour l'identification taxonomique. L'échantillonnage sur le terrain comprenait trois zones différentes : 1) à l'intérieur du parc national de Tai (forêt vierge), 2) sur le périmètre du parc national de Tai (forêt fragmentée) et 3) à proximité du parc national de Tai, près des villages (forêt fragmentée). Dans chaque zone, de l'ADN électronique aquatique a été collecté sur trois sites aquatiques sélectionnés (étangs ou petites rivières), grâce à l'utilisation de kits Spygen, notre partenaire chargé de l'analyse de l'ADN électronique des trématodes et des gastéropodes. Les neuf échantillons d'ADN électronique ont été envoyés à Spygen et nous sommes très curieux de connaître les niveaux de biodiversité qui seront révélés. L'extraction de l'ADN a été réalisée et l'analyse du métabarcoding sera effectuée dans les prochaines semaines avec les échantillons du Cambodge et de la Guadeloupe.

Fig. 2 Procédure de collecte de l'ADN environnemental (ADNe) sur des sites aquatiques, à l'aide des kits de Spygen.
CAMBODGE (Juillet 2023)
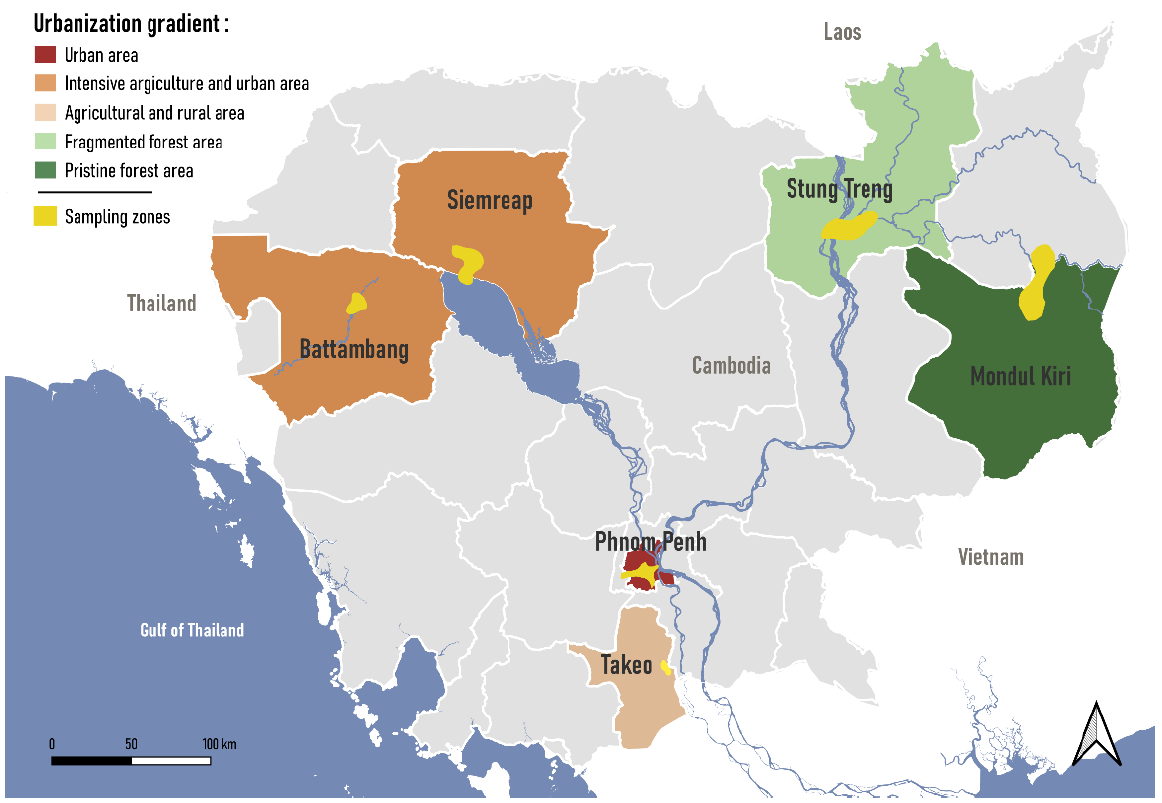
Fig.3 Carte des six zones d'échantillonnage au Cambodge. Les couleurs illustrent le gradient d'urbanisation des zones d'échantillonnage, de la zone urbaine (rouge) à la forêt vierge (vert foncé). Les zones d'échantillonnage spécifiques dans lesquelles les cinq sites d'échantillonnage ont été choisis sont indiquées en jaune.
Accompagnés par les partenaires de l'IFReDI, qui ont partagé avec nous leur expérience de la diversité aquatique, nous avons eu l'occasion de réaliser en juillet 2023 (saison des pluies) la campagne de terrain des communautés aquatiques et de leurs parasites trématodes au Cambodge. L'échantillonnage sur le terrain comprenait six régions géographiques différentes, caractérisées par différents niveaux d'urbanisation (Fig. 2) 1) Battambang (zone d'agriculture intensive) 2) Siem Reap (zone d'agriculture intensive et zone urbaine) 3) Krong Stung Treng (forêt fragmentée) 4) Mondulkiri (forêt vierge) 5) Phnom Penh (zone urbaine) 6) Takeo (zone d'agriculture). Dans chaque région, cinq sites aquatiques différents (étangs ou rivières) ont été échantillonnés, afin d'inclure un autre niveau d'anthropisation (urbain, suburbain, rural, riverain). Sur chaque site, nous avons collecté de l'ADN électronique grâce à des prélèvements d'eau et à l'utilisation des kits Spygen et NatureMetrics (1 kit Spygen pour les escargots et les trématodes et 2 kits NatureMetrics pour les poissons et le microbiome, respectivement), nos partenaires en charge de l'analyse de l'ADN électronique des trématodes et des gastéropodes (Spygen) et des poissons et du microbiome (NatureMetrics). De plus, sur chaque site, nous avons collecté des invertébrés aquatiques en cinq points différents répartis aléatoirement, à l'aide d'un filet de pêche. Après la collecte, les cinq échantillons de chaque site ont été rapidement analysés in situ : les organismes aquatiques ont été séparés du substrat et collectés dans des petits pots en plastique remplis d'éthanol, tandis que le substrat résiduel a été collecté dans des pots plus grands. En outre, afin d'obtenir une base de référence de la végétation, un échantillon contenant des plantes aquatiques et du substrat a été prélevé. La densité des escargots a également été mesurée en collectant des escargots sur des transects verticaux de trois mètres répartis en cinq points dans chaque site. Dans chaque site, des escargots ont également été collectés puis fraîchement disséqués au stéréomicroscope, afin de vérifier la présence et la prévalence des trématodes. En outre, certains escargots ont été achetés sur le marché local et disséqués (10 escargots par espèce, six espèces au total), afin de vérifier la prévalence des trématodes. Les échantillons seront bientôt expédiés aux laboratoires de l'Institut de recherche pour le développement de Montpellier et seront soigneusement examinés au microscope stéréoscopique afin d'identifier les espèces d'invertébrés. Les échantillons d'ADN électronique ont déjà été envoyés à Spygen et NatureMetrics pour une analyse plus approfondie.
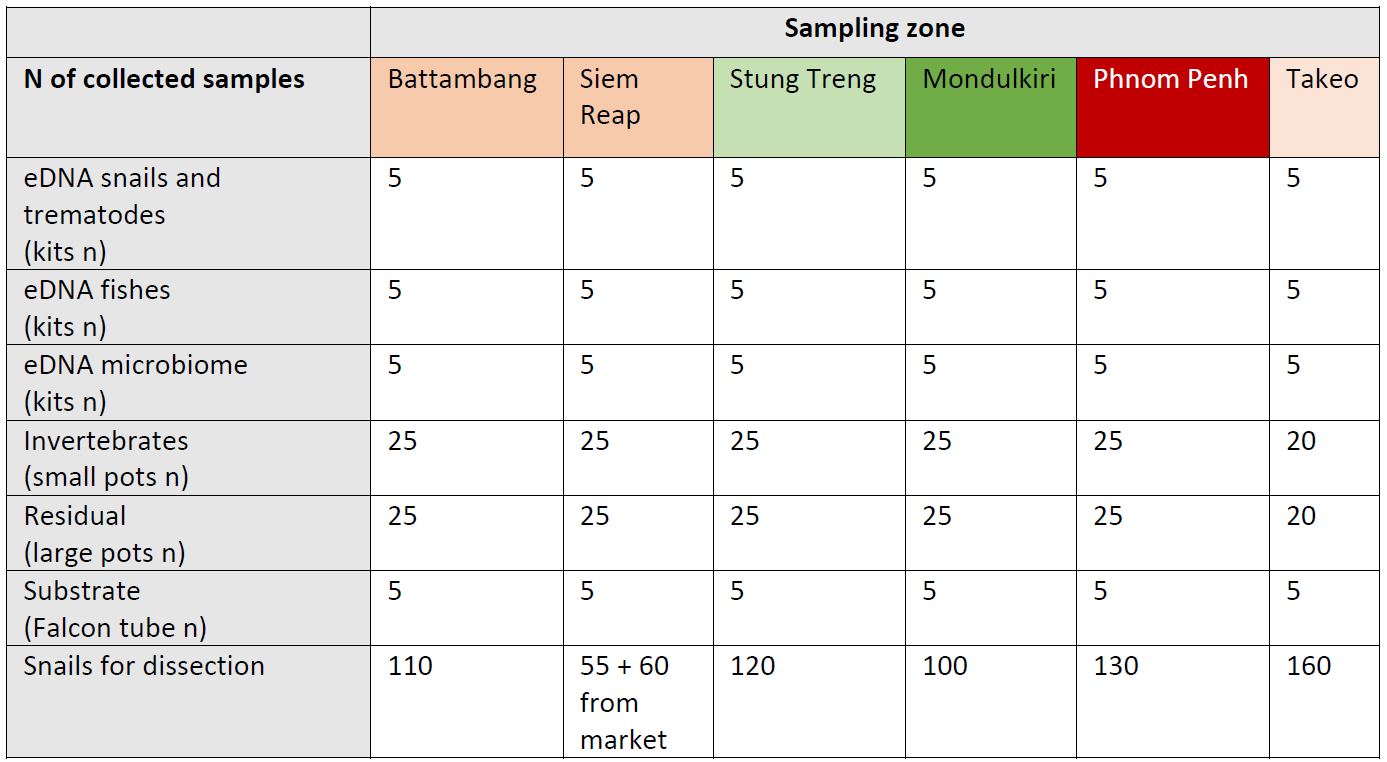
Tableau 1. Nombre et type d'échantillons prélevés dans chaque zone d'échantillonnage. Dans chaque zone, cinq sites différents ont été échantillonnés. Les chiffres du tableau indiquent le nombre total d'échantillons regroupant les cinq sites de chaque zone.
A Phnom Penh, notre équipe a été aimablement hébergée par nos collègues de l'Institut Pasteur du Cambodge, et notamment accueillie par Mme Julia Guillebaud (partenaire de BCOMING et point focal au Cambodge en termes d'administration et de logistique) et le Dr Veasna Duong (chef de l'unité de virologie). Nous sommes reconnaissants à IPC et aux partenaires de l'IFReDI d'avoir contribué au succès de notre échantillonnage, tant sur le plan scientifique que logistique. Au cours de ce voyage, nous avons eu le plaisir de rencontrer de nombreux citoyens, dont l'aide pendant le travail sur le terrain a été précieuse et essentielle ! Nous avons également profité de l'occasion pour leur décrire les principaux objectifs de notre projet et les bénéfices pour la communauté locale. Un autre échantillonnage au Cambodge sera réalisé l'année prochaine pendant la saison sèche (février-mars 2024), en suivant le même itinéraire. Nous nous réjouissons d'ores et déjà de réaliser ce deuxième échantillonnage.

Fig. 5 Notre équipe, composée du Dr Marine Combe (CR, IRD), du Dr Claudia Bommarito (PostDoc, IRD), du Pr Rudy E. Gozlan (DR, IRD) et de Mme Chloé Lefebvre (Technicienne, IRD) de l'Institut national de recherche pour le développement durable (IRD) et de l'Institut des sciences de l'évolution de Montpellier (ISEM), avec nos partenaires de l'Administration des pêches à Battambang.
GUADELOUPE (Octobre 2023)
En octobre 2023, nous avons planifié une sortie de terrain en Guadeloupe, pour collecter de l'ADN électronique aquatique et des hôtes d'escargots. En Guadeloupe, notre équipe sera accueillie par notre partenaire BCOMING, le Dr. Sylvie Lecollinet, de l'Institut CIRAD, qui se joindra également à notre équipe lors de l'échantillonnage sur le terrain. L'échantillonnage sur le terrain comprendra neuf sites, le long d'un transect allant des zones urbaines aux zones vierges (AJOUTER la carte). Dans chaque site, nous collecterons de l'ADN électronique avec les kits Spygen et NatureMetrics et des escargots que nous disséquerons in situ pour vérifier la présence et la prévalence des trématodes. De plus, en collaboration avec le Dr. Severine Fernand de l'Institut Pasteur de Guadeloupe, nous vérifierons également la présence d'Angyostrongylus sp, un nématode responsable de la méningite éosinophile chez l'homme, récemment apparu et qui se propage maintenant en Guadeloupe.Un tel dépistage de la diversité hôte-parasite à l'échelle nationale le long d'un gradient d'urbanisation et au fil des saisons nous permettra non seulement d'identifier les moteurs et les zones à risque d'émergence de la maladie chez l'homme, mais aussi de comparer ces schémas entre différentes zones tropicales.